

前言
上期我们进行了免疫荧光原理、实验步骤的探讨,本期我们一起走进免疫荧光常见问题的分析,帮助大家解决在实验过程中遇到的一些问题,让大家都能成为免疫荧光小能手。
常见问题
1背景荧光高
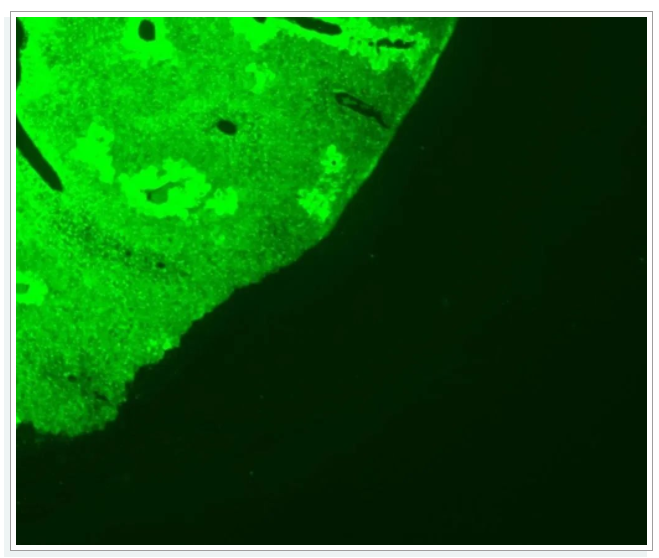
① 洗涤不足——充分洗涤,适当增加洗涤次数和时间;
② 样本干燥——在湿盒中孵育抗体,避免干燥;
③ 抗体浓度过高——预实验测定最佳浓度;
④ 样本自发荧光——染色前先行检测自发荧光情况;
⑤ 封闭不充分——延长封闭时间或更换封闭液;
⑥ 二抗非特异性结合——做一组只加二抗孵育的作为对照;
⑦ 抗体孵育时间过长——严格控制孵育时间,适当减少孵育时间;
⑧ 切片在缓冲液或修复液中浸泡时间太长(大于24小时)——有时切片脱蜡至修复会过夜,第二天加抗体进行染色,如果将装有切片和修复液的容器放在4ºC冰箱过夜,对结果无明显影响,如果放在室温,特别是炎热的夏天,会出现背景着色,因此,不可存放时间太长;
⑨ 荧光背景噪音大——更换荧光显微镜,使用能够降低背景荧光干扰的显微镜。
2荧光信号弱
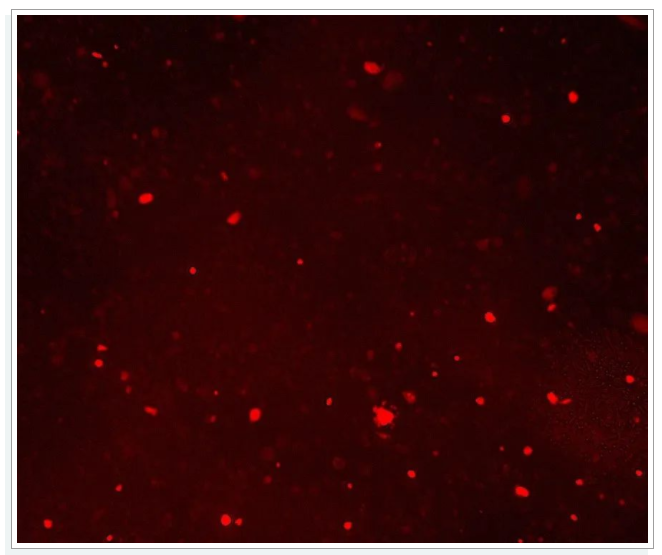
① 荧光通道的激发波长和发射波长与染料不匹配——确保使用的显微镜的荧光通道与染料荧光基团的波长相匹配;
② 一抗或二抗不兼容——注意种属是否正确;
③ 一抗不好用——阳性对照确认抗体有效性;
④ 固定过度或不充分——适当调整固定时间;
⑤ 样本保存不当导致荧光淬灭——注意保存过程中的湿度和避光;
⑥ 一抗变质或质量差的多克隆抗体——注意抗体有效期,与新买抗体或用过的抗体作比较;
⑦ 信号弱或无信号——可裂解细胞后,用WB验证目标蛋白在细胞中是否表达;
⑧ 显微镜收集荧光和成像的能力差——选择一款相机配置好、荧光收集能力强、成像效果好的荧光显微镜。
3细胞/组织形态被破坏
① 组织从玻片上脱落或有气泡——适当增加固定时间,封片时注意不要产生气泡;
② 细胞或组织固定不充分,自发裂解——使用交联性固定剂,适当增加固定时间;
③ 组织切片撕裂或有褶皱——切片过程导致的问题,考虑重新进行切片。
4定位不对
可使用带明场通道的荧光显微镜进行共定位,如下图:

① 细胞核干扰——细胞核位置前面的细胞质染色干扰造成,可以降低抗体浓度或孵育时间;
② 细胞或者组织状态不对——细胞或者组织状态不同导致目的蛋白细胞定位不同,造成最后的定位不对,可重新培养细胞调整好状态或者重新取材,进行再次染色;
③ 核定位不对——可将封闭和打孔合为一步,即在封闭液中添加0.5% TRITON-100,37℃封闭2h,加一抗后最好4℃孵育过夜(16h);
④ 不确定观察到的是不是需要的染色位置——使用带明场通道的荧光显微镜,进行荧光定位,确定观察到的染色位置是否正确。
对照实验设置
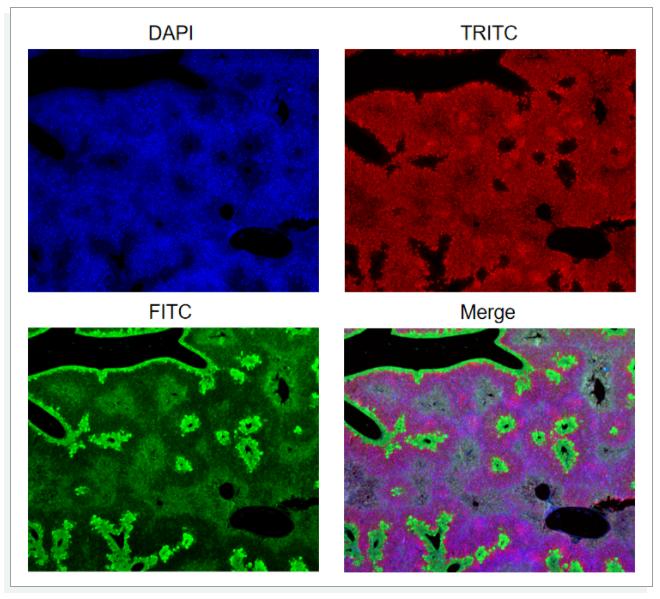
1内源性组织背景对照
某些含有固有的生物化学性质的组织或细胞,会产生背景或自发荧光,对结果产生影响。以下图为例,DAPI染核,FITC染边界和中间的晶状结构,而TRITC染整个组织背景的颜色,但绿色也产生了背景荧光,对三通道叠加造成了干扰。
2阴性对照
使用确定不含有待测抗原的细胞或组织,与待测样本统一处理,同一观察,结果若为阴性,可排除染色过程中由于非特异性染色造成的假阳性。
3阳性对照
与阴性对照相反,用确定含有待测抗原的细胞或组织,与待测样本统一处理,同一观察,结果若为阳性,可证明待测抗原具有活性且实验过程没有问题,方法操作可靠。
免疫荧光高清成像
在精心完成免疫荧光后,选择一款操作简单、成像清晰、效果卓越的荧光显微镜进行观察拍照,才能轻松得到更为理想的结果图,达到事半功倍的效果。
Echo Revolve正倒置一体荧光显微镜作为一款电动化、智能化的显微镜,具有以下优势:
☑ 正倒置一体快速切换——切片、细胞观察随心切换,无惧任何耗材;
☑ DHR数字降噪功能——极大地降低了背景噪音和荧光干扰,提高图像锐度,加深细节,得到分辨率更高的图片;
☑ 强大的Z-Stacking功能——通过高精度电动化Z轴层扫来扩大景深,解决厚样本观察问题,提高图像分辨率;
☑ 500MP单色相机——能够采集更多荧光信号,助力低荧光强度样本观察;
☑ 多通道荧光自动拍摄叠加功能——可自动进行多通道成像的叠加,个性化选择查看/保存各通道的组合图像。

