

1、前言
逆转录是以RNA为模板合成DNA的过程,即RNA指导下的DNA合成。在逆转录过程中必不可少的逆转录酶,除了其依赖RNA的DNA聚合酶活性,还需要镁离子或锰离子等辅助因子,同时包括依赖于DNA的DNA聚合酶活性和RNase H活性,它可以降解DNA与RNA杂交链中的RNA链。与典型的DNA聚合酶不同,逆转录酶缺乏校对功能,在PCR实验中逆转录酶存在抑制Taq聚合酶活性的功能,进而导致不准确的测定结果。
目前,最常用的逆转录酶类型有两种,一是来自禽类成髓细胞瘤病毒(AMV)的逆转录酶,二是来自莫洛尼小鼠白血病病毒(M-MLV)的逆转录酶。AMV逆转录酶相对于其他类型的逆转录酶,它更具有加工性,具有更高的最佳活性温度范围(42~48°C),更适合逆转录具有较强二级结构的RNA。然而,AMV逆转录酶具有相对较高的RNase H活性,这使其在合成长转录本方面的作用较小。相比之下,M-MLV 逆转录酶是由一个单一的亚基组成,具有较低的RNase H活性,由于这些特性,M-MLV RT经常被用于较长的转录本。M-MLV逆转录酶最适活性温度为37°C。许多M-MLV变体是可用的,包括RNase H点突变体,它们更耐热,更适合复杂困难的模板。
2、工作流程和用途
逆转录可用于生成适合各种下游应用的cDNA。
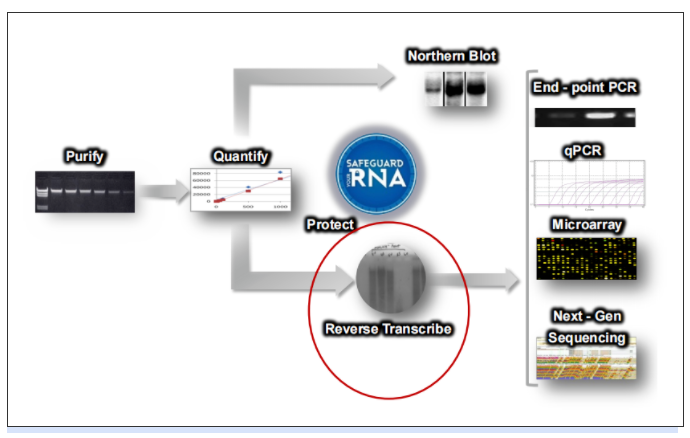
▲ 图1 RNA工作流程
在某些情况下,逆转录和实时荧光定量PCR在一个单一的反应混合液中反应时,称为一步法RT-qPCR。当逆转录和实时PCR在不同的反应混合液中发生时,被称为两步法RT-qPCR。
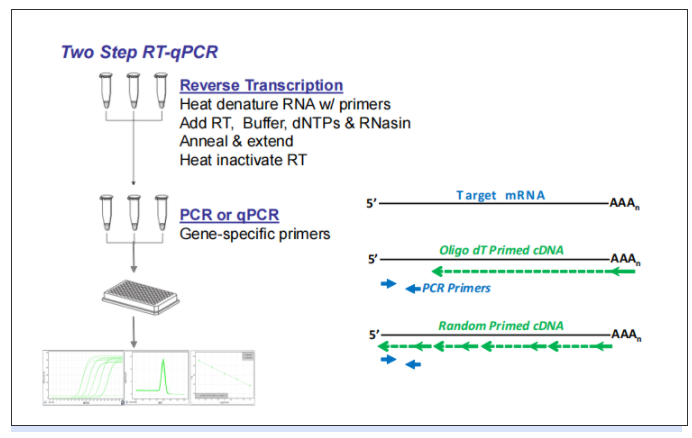
▲ 图2 两步法RT-qPCR工作流程
当需要大量cDNA通过PCR或qPCR研究多个转录本时,两步法是首选。在一步法RT-qPCR中,目标序列在同一反应孔或容器中进行逆转录和qPCR扩增。用随机引物或oligo(dT)引物代替目标特异性引物。一步法RT-qPCR相对于两步法RT-qPCR需要的样本更少。此外,任何技术重复之间的方差都可以用来评估这两个酶促步骤的联合可变性。一步法RT- qPCR经常被用于RNA的定量和质量控制。一步法可能的劣势在于引物设计更复杂,因为引物必须在逆转录和PCR温度下同时发挥作用。
3、考量点
理想情况下,每一个靶向转录的RNA或mRNA分子都将转化为一个cDNA分子,即所有的靶RNA都将以相同的效率转录。然而,RT效率的可变性,无论是由于RNA样本质量、引物设计、RT酶的选择,还是其他因素,都会影响所产生的代表RNA分子在样本中的分布程度的cDNA。RT效率的变化是在RT-qPCR反应总体结果质量中一个被严重低估的因素,其影响已延伸到大量已发表的基因表达研究。MIQE指南中概述的如样本、核酸提取和逆转录细节,均是为了可以获得有效的RT-qPCR结果。成功的逆转录考量参数有以下几点:
RNA纯化和纯度:
在选择RNA提取方法时,需要考虑许多参数,但理想情况下,RNA样本应该不受污染蛋白质,如核酸酶,这可能会干扰cDNA合成和下游应用。产量是一个主要的考虑因素,然而,有效地去除基因组DNA(gDNA)同样重要。即使是少量的gDNA污染也会导致qPCR结果的可变性,而大量的gDNA污染也会导致直接的定量错误。减少对gDNA污染一种方法是在RNA分离方法中加入一个DNase酶消化的步骤。此外,应使用无逆转录酶对照(无RT)来确定RNA样本中是否存在gDNA。
RNA完整性:
RNA样本的完整性对于许多下游应用都是至关重要的。完整的真核生物的RNA一个重要特征是同时存在28S和18S核糖体RNA(rRNA)(图3)。这些条带的存在和整体RNA质量可以通过琼脂糖凝胶电泳和其他方法来评估。理想情况下,在琼脂糖凝胶上显示时,28S带的亮度应该是18S带的两倍,尽管大致相等的亮度也可以表明RNA在大多数应用中具有足够高的质量。
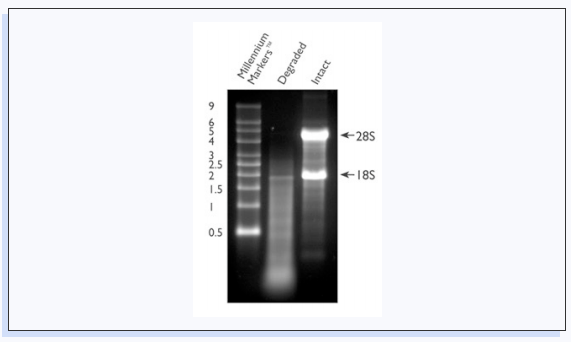
▲ 图3:RNA完整性电泳图,RNA降解导致拖带现象
逆转录引物:
cDNA合成通常涉及使用三种引物中的一种:Oligo(dT)引物、随机引物(Random primer)或基因特异性引物。随机引物是一种随机序列的短寡核苷酸,对于长(>4kb)或缺乏poly (A)尾巴的转录本,如原核mRNA的情况,它们可以在转录本的多个点上启动逆转录,因此,它们对于长mRNA和具有重要二级结构的转录本很有用。通常使用随机六聚体引物,使用随机八或九聚体引物可以促进更长的cDNA合成,因为它们杂交的频率较低。基因特异性引物通常用于一步(偶联)RT-PCR。这些方法通过将所有逆转录酶活性引导到特定的信息,而不是转录整个RNA来提高敏感性。对于目标扩增子长度约为100bp或以下的RT-qPCR应用,使用更高浓度的随机引物可能是有利的。设计跨越内含子或内含子-外显子边界的引物可以确保cDNA是由剪接的mRNA序列合成的,而不是gDNA中的亲本基因序列合成。经过生物素修饰或在5‘端添加序列标签等修饰的引物可用于纯化和/或分析由特定义或反义模板链合成的cDNA。
RNA的二级结构:
RNA分子具有影响逆转录的二级结构,而高GC含量会降低逆转录效率。在逆转录或cDNA合成前高温变性处理,可能有利于困难模板的逆转录。RNA可以通过在65°C下变性5分钟来打开其二级结构。
cDNA的qPCR定量:
强烈建议在cDNA合成后进行RT酶的热失活处理。RT酶失活后,要么直接通过qPCR对cDNA进行目标特异性的定量分析,要么将灭活的反应液冷冻保存,直到需要时才使用。qPCR反应混合物通常可容纳cDNA样本体积的增加,最高可占总反应体积的20%。cDNA可以作为未稀释的逆转录反应产物直接添加到qPCR中,也可以稀释后进行qPCR反应。cDNA的定量是RT-qPCR工作流程成功的关键。一般来说,作为模板的cDNA的量不应超过投入100ng总RNA逆转录后所得的量。由高度丰富的转录本产生的cDNA可以在不到1pg的总RNA中检测到。
4、总结
逆转录是RT-qPCR和其他广泛应用的关键步骤,我们必须仔细考虑RNA模板质量和实验设计细节,并清楚了解RT效率和RT偏差程度等性能特征。MIQE指南提供了一个实验设计细节框架,遵循相应准则可以获得有效且准确的RT-qPCR结果。
